EUDAMED – nowości!
Komisja Europejska opublikowała projekt „RoadMap” dla EUDAMED z zaktualizowanymi harmonogramami dla każdego modułu i datami ich obowiązkowego stosowania MDR i IVDR.
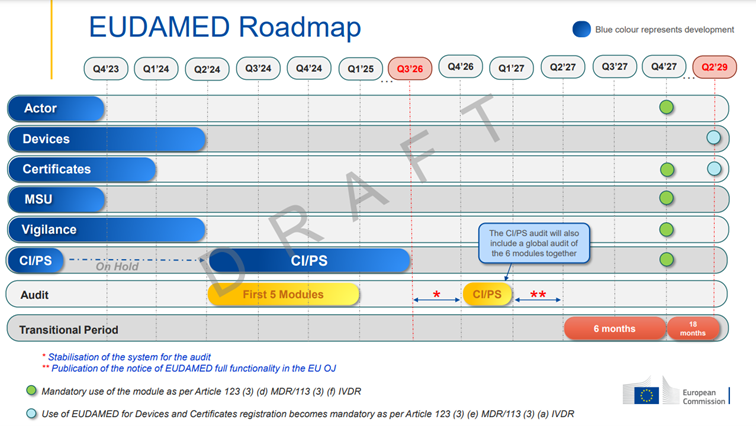
* Stabilizacja systemu na potrzeby audytu
** Publikacja zawiadomienia o pełnej funkcjonalności EUDAMED w dzienniku ustaw
- Obowiązkowe stosowanie modułu zgodnie z art. 123 (3) (d) MDR/113 (3) (f) IVDR
Korzystanie z EUDAMED do rejestracji wyrobów i certyfikatów staje się obowiązkowe zgodnie z art. 123 ust. 3 lit. e) MDR/113 ust. 3 lit. a) IVDR.
https://health.ec.europa.eu/system/files/2023-10/md_eudamed_roadmap_en.pdf
Komisja Europejska wyznaczyła cel w postaci w pełni operacyjnej bazy danych EUDAMED do drugiego kwartału 2024 roku!
Oś czasu i okres przejściowy
Gdy EUDAMED będzie w pełni funkcjonalny, branża będzie miała 6 lub 24 miesiące, zanim korzystanie z systemu stanie się obowiązkowe. Dłuższy okres przejściowy dotyczy modułów unikalnego identyfikatora urządzenia (UDI)/urządzenia i certyfikatu jednostki notyfikowanej.
Moduły EUDAMED
EUDAMED składa się z sześciu połączonych ze sobą modułów i strony publicznej:
- Użytkownicy – rejestracja i zarządzanie użytkownikami
- Baza danych UDI i rejestracja urządzeń
- Certyfikaty i jednostki notyfikowane
- Badania kliniczne i badania działania
- Bezpieczeństwo i nadzór po wprowadzeniu do obrotu
- Nadzór rynku



